Dissociação
Iônica/Ionização
ð Dissociação
Iônica: Separação, apenas, dos compostos iônicos em solução aquosa.
Exemplo: NaCl
= Na+ + Cl-
ð Ionização: Formação de íons na
solução aquosa.
Exemplo: HCl
= H+ + Cl-
Grau
de ionização
Representado pela letra α (alfa), é a relação que existe entre o
número de moléculas ionizadas e o número total de moléculas dissolvidas.

E podemos classificar o ácido em forte, fraco ou moderado de acordo com
seu grau de ionização. Observe a tabela abaixo:

Acidez => pH
Obs.: Lembrando que isso é
considerado a temperatura de 25ºC
Constante
de equilíbrio
Valor que relaciona a concentração dos produtos com a do reagente no
momento em que ocorre o equilíbrio.

Obs.: Kc representa o valor das
constantes de equilíbrio a uma temperatura de 25ºC. Em caso da ocorrência da reação em fase gasosa, a
constante é expressa Kp, em
função da pressões dos elementos.
Lei de Diluição de Ostwald
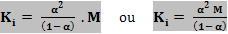
Obs.: A
segunda fórmula deve ser usada apenas para substâncias com K < ou = a 5%
Equilíbrio em solução aquosa
A relação entre a concentração de íons
Hidrogênio e o valor pH é definido pela equação :pH = - log[H+]
Da mesma forma podemos utilizar essa terminologia para caracterizar a concentração de íons OH- em uma solução básica :
pOH = - log[OH-]
Todos os logarítnos citados acima estão na base 10 e K pode ser qualquer valor de constante de equilíbrio.
A relação entre os valores de pH e pOH é definida como :
pH + pOH = 14
Isso ocorre porque à 25o C o produto iônico da água é 10-14
H2O = H+ + OH-
Portanto o produto das concentrações dos íons H+ e OH- deve ser 10-14
Utilizando as propriedades dos logarítmos :
[H+].[ OH-] = 10-14
log [H+].[ OH-] = log 10-14
log [H+] + log [OH-] = -14
- log [H+] - log [OH-] = 14
pH + pOH = 14
Hidrólise Salina
ð Ácido fraco/forte => pH <7
ð Base fraca/forte => pH <7
ð Sal?
Base forte com ácido forte
=> solução neutra (pH = 7)
Base forte com ácido fraco
=> solução alcalina (pH > 7)
Concentração de OH menor que
de H => solução ácida (pH < 7)
Concentração de OH maior que
de H => solução alcalina (pH > 7)
Se: Ka = Kb => Solução Neutra
Ka > Kb => Solução Ácida
Ka < Kb => Solução Básica
Obs.:
|
Resumindo
|
pH
|
pOH
|
|
Neutro
|
=7
|
=7
|
|
Ácido
|
<7
|
>7
|
|
Alcalino
|
>7
|
<7
|


Nenhum comentário:
Postar um comentário