OXIDORREDUÇÃO
Oxidação Redução
NOX aumenta NOX diminui
Agente Redutor Agente Oxidante
Regras para atribuição de oxidação (NOX)
- Toda a substância simples tem nox = zero. Ex: Zn º, H2º
- Na tabela periódica as famílias 1A -> nox = +1,
2A -> nox = +2.
Exceções: Al = +3, Zn = +2, Ag = +1 - Hidrogênio H + Ametal -> nox = +1
H + Metal -> nox = -1 - Oxigênio nox = -2
peróxido -> H2O2 nox = -1
OF2 -> nox = +2 - Balanceamento
Regras para balanceamento de reações de oxidorredução
Quanto maior o potencial de redução de um elemento, maior a tendência em ganhar elétrons.Portanto, ele recebe elétrons de um outro elemento de menor potencial de redução.
Para o potencial de oxidação, quanto maior o valor de E0, maior a tendência em perder elétrons e, portanto, ceder elétrons para outro elemento de menor potencial de oxidação.
![]()
Regras para sabermos se a reação é espontânea ou não
- Atribuição dos números de oxidação
- oxidação/redução -> Agente Redutor/ Agente Oxidante
- Balancemamento dos números de elétrons
- Acertar o número de átomos -> H2O
- Acertar o número de átomos de hidrogênio ->H+
Para o potencial de oxidação, quanto maior o valor de E0, maior a tendência em perder elétrons e, portanto, ceder elétrons para outro elemento de menor potencial de oxidação.
Dados:
Cu2+ + 2 e– ® Cu° E = + 0,34 V
Zn2+ + 2 e– ® Zn° E = – 0,76 V
Regras para sabermos se a reação é espontânea ou não
- verificar, no sentido indicado da reação, a espécie que sofre oxidação (perde e–) e a espécie que sofre redução (ganha e–)
- se a espécie que sofre redução apresentar um
 maior que o da espécie que sofre oxidação, a reação é espontânea; caso contrário, não.
maior que o da espécie que sofre oxidação, a reação é espontânea; caso contrário, não.






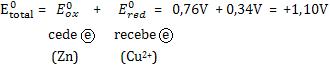


Nenhum comentário:
Postar um comentário